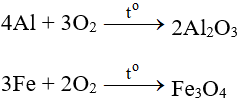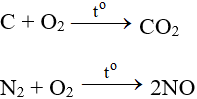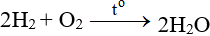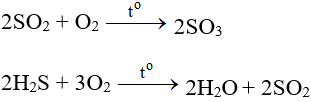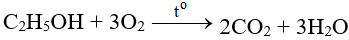CO + O2 → CO2 | CO ra CO2
Sinx.edu.vn xin giới thiệu phương trình CO + O2 → CO2 là phản ứng hóa hợp. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng CO + O2 → CO2
1. Phương trình CO cháy trong không khí
2CO + O2 2CO2
2. Điều kiện phản ứng CO cháy trong oxi
Nhiệt độ.
3. Cách thực hiện phản ứng
Đốt cháy khí CO trong oxi.
4. Hiện tượng nhận biết phản ứng
CO cháy trong oxi hay không khí có ngọn lửa màu xanh và tỏa nhiều nhiệt
5. Bản chất của CO (Cacbon oxit) trong phản ứng
Phân tử CO có liên kết ba bền vững nên ở nhiệt độ thường rất trơ, chỉ tác dụng được với các phi kim như O2, Cl2,... trong điều kiện nhiệt độ cao.
6. Tính chất hóa học của CO
CO là chất khí không màu, không mùi, ít tan trong nước, hơi nhẹ hơn không khí (dCO/kk = 28/29), rất độc.
6.1. CO là oxit trung tính
Ở điều kiện thường CO không phản ứng với nước, axit, bazơ.
6.2. CO là chất khử
Ở nhiệt độ cao, CO khử được nhiều oxit kim loại
CO + CuO → CO2 + Cu
2CO + Fe3O4 → 3Fe + 2CO2
2CO + O2 → 2CO2
7. Tính chất vật lý của CO
Cacbon monoxit sẽ có công thức phân tử CO theo dạng C≡O. Trong đó có một liên kết theo dạng cho nhận với phân tử khối 28.
8. Tính chất hóa học của O2
- Khi tham gia phản ứng, nguyên tử O dễ dàng nhận thêm 2e. Nguyên tử oxi có độ âm điện lớn (3,44), chỉ kém flo (3,98).
- Do vậy, oxi là nguyên tố phi kim hoạt động hoá học, có tính oxi hoá mạnh. Trong các hợp chất (trừ hợp chất với flo), nguyên tố oxi có số oxi hoá là -2.
- Oxi tác dụng với hầu hết các kim loại (trừ Au, Pt, ...) và các phi kim (trừ halogen). Oxi tác dụng với nhiều hợp chất vô cơ và hữu cơ.
8.1. Tác dụng với kim loại
Tác dụng với hầu hết kim loại (trừ Au và Pt), cần có to tạo oxit:
8.2. Tác dụng với phi kim
Tác dụng với hầu hết phi kim (trừ halogen), cần có to tạo oxit:
ĐB: Tác dụng với H2 nổ mạnh theo tỉ lệ 2:1 về số mol:
8.3. Tác dụng với hợp chất
- Tác dụng với các chất có tính khử:
- Tác dụng với các chất hữu cơ:
9. Bạn có biết
CO là một khí rất độc nó ảnh hưởng đến sức khỏe, nếu nghiêm trọng có thể dẫn đến hôn mê hoặc tử vong khi hít phải.
10. Bài tập vận dụng
Câu 1. Nhận định nào sau đây sai?
A. Cacbon monoxit không tạo ra muối và là một chất khử mạnh.
B. Ở nhiệt độ cao cacbon có thể khử được tất cả các oxit kim loại giải phóng kim loại.
C. than gỗ được dùng để chế thuốc súng, thuốc pháo, chất hấp phụ.
D. than muội được dùng để làm chất độn cao su, sản xuất mực in, xi đánh giầy.
Lời giải:
Đáp án: B
Câu 2. Trong các chất sau: BaO, Mn2O7, P2O5, CO, Fe2O3, SiO2, CuO, H2S, NH3. Dãy gồm các oxit bazơ là
A. CO, Fe2O3, SiO2.
B. BaO, Mn2O7, H2S.
C. Fe2O3, SiO2, NH3.
D. BaO, Fe2O3, CuO.
Lời giải:
Đáp án: D
Câu 3. Những nhận định nào dưới đây không đúng về khí oxy?
(1) Oxy tồn tại ở thể khí ở điều kiện nhiệt độ phòng.
(2) Khí oxy tan nhiều trong nước.
(3) Khí oxy duy trì sự sống và sự cháy.
(4) Trong không khí, oxy chiếm 78% về thể tích.
(5) Khí oxy không màu, không mùi, không vị.
(6) Thu khí oxy trong phòng thí nghiệm bằng cách đẩy không khí
A. (1), (2), (6)
B. (2), (4),
C. (3), (4), (5)
D. (1), (5)
Lời giải:
Đáp án: B
Giải thích:
(2) không đúng vì khí oxygen ít tan trong nước.
(4) không đúng vì trong không khí, oxygen chiếm 21% về thể tích.
Câu 4. Nhận định đúng về tính chất vật lí của cacbon oxit là
A. chất khí nặng hơn không khí.
B. chất khí không màu, không mùi, rất độc.
C. chất khí tan nhiều trong nước.
D. chất lỏng ở điều kiện thường.
Lời giải:
Đáp án: B
Giải thích:
Cacbon oxit là chất khí không màu, không mùi, ít tan trong nước, hơi nhẹ hơn không khí (dCO/kk = 28/29), rất độc.
A sai vì cacbon oxit là chất khí nhẹ hơn không khí.
B đúng vì cacbon oxit là chất khí không màu, không mùi, rất độc.
C sai vì cacbon oxit là chất khí ít tan trong nước.
D sai vì cacbon oxit là chất khí ở điều kiện thường.
Câu 5. Dãy chất nào sau đây đều tác dụng với khí oxi?
A. C2H4, Ag, Al, Fe, CuO.
B. BaCO3, K, Na, Cu, S.
C. C2H4, Na, Al, Fe, S.
D. C2H6O, Mg, CO2, P, CH4.
Lời giải:
Đáp án: C
Câu 6. CO khử được oxit kim loại nào sau đây?
A. Al2O3.
B. BaO.
C. Fe2O3.
D. MgO.
Lời giải:
Đáp án: C
Giải thích:
Ở nhiệt độ cao, các chất CO, H2, C khử được các oxit của kim loại đứng sau Al trong dãy hoạt động hóa học.
⟹ CO khử được oxit Fe2O3.
Câu 7. Ở nhiệt độ cao, khí CO khử được các oxit nào sau đây
A. Fe2O3 và CuO
B. Al2O3 và CuO
C. MgO và Fe2O3
D. CaO và MgO.
Lời giải:
Đáp án: A
Giải thích:
Ở nhiệt độ cao, khí CO, H2 có thể khử được các oxit kim loại đứng sau Al trong dãy điện hóa.
=> Các chất thỏa mãn là: Fe2O3 và CuO.
Câu 8. CO không khử được các oxit trong nhóm nào sau đây?
A. Fe3O4, MgO
B. MgO, Al2O3
C. Fe3O4, CuO
D. ZnO, Fe3O4
Lời giải:
Đáp án: B
Câu 9. Nung 17,3 gam hỗn hợp gồm Ca(HCO3)2, NaHCO3 và KHCO3, thu được 1,8 gam H2O và m gam hỗn hợp các muối cacbonat. Giá trị của m là
A. 11,1.
B. 22,2.
C. 17,8.
D. 26,6.
Lời giải:
Đáp án: A
Giải thích:
nH2O = nCO2 = 0,1 mol
mmuối cacbonat = mhỗn hợp – mCO2 – mH2O = 17,3 – 0,1.44 – 1,8 = 11,1 gam
Câu 10. Trong bình kín chứa 5,6 lít CO ở đktc và m gam Fe3O4. Đun nóng bình cho tới khi phản ứng xảy ra hoàn toàn thì khí trong bình có tỉ khối so với khí CO ban đầu là 1,457. Giá trị của m là
A. 17,4.
B. 11,6.
C. 22,8.
D. 23,2.
Lời giải:
Đáp án: B
Giải thích:
nCO = 0,25 mol
Khí trong bình sau phản ứng có CO2 và CO ( dư)
CO + [O] → CO2
x → x → x (mol)
Sau phản ứng: nCO = 0,25 – x; nCO2 = x ⇒ nkhí sau = 0,25 mol
Ta có: mCO2 + mCO = 44x + 28.(0,25 – x) = 1,457.28.0,25
⇒ x = 0,2 ⇒ nO(Fe3O4) = 0,2 ⇒ nFe3O4 = 0,05 mol
⇒ m = 0,05. 232 = 11,6 gam