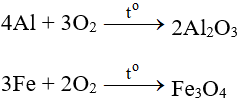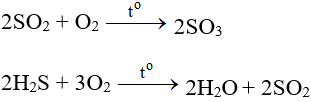SO2 + O2 → SO3 | SO2 ra SO3
Sinx.edu.vn xin giới thiệu phương trình SO2 + O2 → SO3 là phản ứng hóa hợp. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng SO2 + O2 → SO3
1. Phương trình phản ứng
2SO2 + O2 2SO3
2. Điều kiện để phản ứng SO2 ra SO3
Oxi hóa SO2 bằng khí oxi hoặc không khí dư ở nhiệt độ 450 - 500oC, chất xúc tác vanađi (V) oxit V2O5.
3. Tính chất hóa học của SO2
Là chất khí không màu, nặng hơn không khí, mùi hắc, độc, tan và tác dụng được với nước.
* SO2 là oxit axit
3.1 Lưu huỳnh đioxit Tác dụng với nước
SO2+ H2O ⇋ H2SO3
3.2. Lưu huỳnh đioxit Tác dụng với dung dịch bazơ
(có thể tạo thành 2 loại muối sunfit và hiđrosunfit)
SO2 + NaOH → NaHSO3
SO2 + 2NaOH → Na2SO3 + H2O
3.3. Lưu huỳnh đioxit Tác dụng với oxit bazơ → muối
SO2 + CaO → CaSO3
* SO2vừa là chất khử, vừa là chất oxi hóa (do S trong SO2 có mức oxi hóa trung gian +4)
3.4. Lưu huỳnh đioxit là chất oxi hóa
SO2 + 2H2S → 3S + 2H2O
3.5. Lưu huỳnh đioxit là chất khử
2SO2 + O2 ⇋ 2SO3 (V2O5, 4500C)
Cl2 + SO2 + 2H2O → H2SO4 + 2HCl
5SO2 + 2KMnO4 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4
SO2 + Br2+ 2H2O → H2SO4 + 2HBr
4. Ứng dụng của SO2
- Trong phòng thí nghiệm, SO2 được điều chế bằng cách cho muối sunfit tác dụng với axit mạnh như HCl, H2SO4.
Ví dụ: Na2SO3 + 2 HCl → 2 NaCl + H2O + SO2
- Ngoài ra, khí SO2 còn được điều chế bằng cách cho Cu tác dụng với H2SO4 đặc.
Cu + 2H2SO2 đặc → CuSO4 + SO2 + 2H2O
Khí SO2 được thu bằng phương pháp đẩy không khí.
5. Tính chất hóa học của O2
- Khi tham gia phản ứng, nguyên tử O dễ dàng nhận thêm 2e. Nguyên tử oxi có độ âm điện lớn (3,44), chỉ kém flo (3,98).
- Do vậy, oxi là nguyên tố phi kim hoạt động hoá học, có tính oxi hoá mạnh. Trong các hợp chất (trừ hợp chất với flo), nguyên tố oxi có số oxi hoá là -2.
- Oxi tác dụng với hầu hết các kim loại (trừ Au, Pt, ...) và các phi kim (trừ halogen). Oxi tác dụng với nhiều hợp chất vô cơ và hữu cơ.
5.1. Tác dụng với kim loại
Tác dụng với hầu hết kim loại (trừ Au và Pt), cần có to tạo oxit:
5.2. Tác dụng với phi kim
Tác dụng với hầu hết phi kim (trừ halogen), cần có to tạo oxit:
ĐB: Tác dụng với H2 nổ mạnh theo tỉ lệ 2:1 về số mol:
5.3. Tác dụng với hợp chất
- Tác dụng với các chất có tính khử:
- Tác dụng với các chất hữu cơ:
6. Bài tập vận dụng
Câu 1. Lưu huỳnh có các số oxi hóa nào dưới đây?
A. -2; 0; -4; +4
B. 0; +4; -1; +6
C. 0; -1; -2; +6
D. -2; 0; +4; +6
Lời giải:
Đáp án: D
Câu 2. Một mẫu khí thải có chứa các khí H2S, NO2, SO2, CO2 được sục vào dung dịch CuSO4, thấy xuất hiện kết tủa màu đen. Hiện tượng này do chất nào có trong khí thải gây ra?
A. H2S.
B. NO2.
C. SO2.
D. CO2.
Lời giải:
Đáp án: A
Câu 3. Khí CO2 có lẫn SO2. Trong các hóa chất sau:
(1) dung dịch NaOH;
(2) dung dịch Br2;
(3) dung dịch KMnO4;
(4) dung dịch Na2SO3;
(5) nước vôi trong;
(6) khí O2.
Có bao nhiêu hóa chất có thể sử dụng để loại bỏ khí SO2 ra khỏi CO2.
A. 4
B. 5
C. 3
D. 2
Lời giải:
Đáp án: C
Giải thích:
Các hóa chất có thể dùng để loại khí SO2ra khỏi CO2 là:
(2) dung dịch Br2;
Có khí SO2làm mất màu dung dịch Brom
SO2 + Br2 + 2H2O → 2HBr + H2SO4
(3) dung dịch KMnO4;
5SO2 + 2KMnO4 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4
(4) dung dịch Na2SO3
Na2SO3 + 2CO2 + H2O → 2NaHCO3 + SO2
Câu 4. Khi làm thí nghiệm với H2SO4 đặc, nóng thường sinh ra khí SO2. Để hạn chế tốt nhất khí SO2 thoát ra gây ô nhiễm môi trường, người ta nút ống nghiệm bằng bông tẩm dung dịch nào sau đây:
A. cồn.
B. muối ăn.
C. xút.
D. giấm ăn.
Lời giải:
Đáp án: C
Giải thích:
Để hạn chế khí SO2 bay ra, người ta sử dụng bông tẩm xút vì xút có khả năng phản ứng:
SO2 + 2NaOH → Na2SO3 + H2O
Câu 5. SO2 vừa có tính oxi hóa, vừa có tính khử vì trong phân tử SO2
A. S có mức oxi hóa trung gian.
B. S có mức oxi hóa cao nhất.
C. S có mức oxi hóa thấp nhất.
D. S còn có một đôi electron tự do.
Lời giải:
Đáp án: A
Giải thích:
SO2 vừa có tính oxi hóa, vừa có tính khử vì trong phân tử SO2 thì S có mức oxi hóa trung gian.
Câu 6: Khí CO2 có lẫn SO2. Trong các hóa chất sau:
(1) dung dịch NaOH;
(2) dung dịch Br2;
(3) dung dịch KMnO4;
(4) dung dịch Na2SO3;
(5) nước vôi trong;
(6) khí O2.
Có bao nhiêu hóa chất có thể sử dụng để loại bỏ khí SO2 ra khỏi CO2.
A. 4
B. 5
C. 3
D. 2
Lời giải:
Đáp án: C
Giải thích:
Các hóa chất có thể dùng để loại khí SO2 ra khỏi CO2 là:
(2) dung dịch Br2;
(3) dung dịch KMnO4;
(4) dung dịch Na2SO3
Câu 7: Trong các phản ứng dưới đây, số phản ứng trong đó S thể hiện tính khử là
S + O2 SO2
S + 3F2 SF6
S + Hg → HgS
S + 6HNO3 (đặc) H2SO4 + 6NO2 + 2H2O
A. 3
B. 2
C. 4
D. 1
Lời giải:
Đáp án: A
Câu 8. Hơi thủy ngân rất dộc, bởi vậy khi làm vỡ nhiệt kế thủy ngân thì chất bột được sử dụng để rắc lên thủy ngân rồi gom lại chính là:
A. vôi sống.
B. cát.
C. muối ăn.
D. lưu huỳnh.
Lời giải:
Đáp án: D
Câu 9. Ứng dụng chính của lưu huỳnh là:
A. Chế tạo dược phẩm, phẩm nhuộm
B. Sản xuất axit H2SO4
C. Lưu hóa cao su
D. Chế tạo diêm, thuốc trừ sâu, diệt nấm
Lời giải:
Đáp án: B
Câu 10. Tính chất vật lí nào sau đây không phải của lưu huỳnh
A. chất rắn màu vàng, giòn
B. không tan trong nước
C. có tnc thấp hơn ts của nước
D. tan nhiều trong benzen, ancol etylic
Lời giải:
Đáp án: D
Câu 11. Dãy các chất nào sau đây tan trong nước?
A. Al2O3, CaO, P2O5, CuO, CO2
B. CuO, CaO, P2O5, CO, CO2
C. Na2O, CaO, P2O5, SO3, SO2
D. Fe2O3, BaO, SO2, SO3, CO2
Lời giải:
Đáp án: C
Giải thích:
Phương trình phản ứng
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
P2O5 + 3H2O → 2H3PO4
SO3 + H2O → H2SO4
SO2 + H2O → H2SO3
Câu 12. Ngâm một đinh sắt sạch trong dung dịch đồng (II) sunfat có màu xanh. Hiện tượng xảy ra là:
A. Chỉ có màu xanh của dung dịch ban đầu nhạt dần.
B. Chỉ một phần đinh sắt bị hoà tan.
C. Kim loại đồng màu đỏ bám ngoài đinh sắt, đinh sắt không bị hoà tan.
D. Một phần đinh sắt bị hoà tan, kim loại đồng màu đỏ bám ngoài đinh sắt, màu xanh của dung dịch ban đầu nhạt dần.
Lời giải:
Đáp án: D
Giải thích:
Fe + CuSO4 → FeSO4+ Cu
Khi cho đinh sắt vào dung dịch CuSO4, đinh sắt bị hòa tan , kim loại đồng bám ngoài đinh sắt, dung dịch CuSO4 tham gia phản ứng ( tạo nên FeSO4) nên màu xanh của dung dịch ban đầu bị nhạt dần
Câu 13. Khí CO thường được dùng làm chất đốt trong công nghiệp. Một loại khí CO có lẫn tạp chất CO2, SO2. Hoá chất rẻ tiền nào sau đây có thể loại bỏ những tạp chất trên ra khỏi CO?
A. H2O cất.
B. dung dịch HCl.
C. dung dịch Ca(OH)2
D. dung dịch xút.
Lời giải:
Đáp án: C
Câu 14. Khi sục SO2 vào dung dịch H2S thì xảy ra hiện tượng nào sau đây?
A. Dung dịch bị vẩn đục màu vàng.
B. Tạo thành chất rắn màu đỏ.
C. Không có hiện tượng gì.
D. Dung dịch chuyển thành màu nâu đen.
Lời giải:
Đáp án: A
Giải thích:
Lưu huỳnh đioxit là chất oxi hóa khi cho lưu huỳnh đioxit tác dụng với dung dịch hiđrosunfua
Lưu huỳnh đioxit là chất oxi hóa khi tác dụng với chất khử mạnh hơn
Khi dẫn khí SO2 vào dung dịch axit H2S dung dịch bị vẩn đục màu vàng (S). SO2 đã oxi hóa H2S thành S
Khi sục SO2vào dung dịch H2S thì xảy ra phản ứng:
SO2 + 2H2S → 3S↓ + 2H2O
Câu 15. Dẫn khí SO2 vào dung dịch KMnO4 có hiện tượng gì xảy ra
A. Dung dịch bị mất màu
B. Dung dịch bị mất màu tím của thuốc tím KMnO4
C. Xuất hiện kết tủa màu trắng
D. Mất màu dung dịch da cam ban đầu
Lời giải:
Đáp án: B
Giải thích:
Dẫn khí SO2 vào dung dịch KMnO4 màu tím nhận thấy dung dịch bị mất màu, vì xảy ra phản ứng hóa học sau:
5SO2 + 2KMNO4 + 2H2O → 2MnSO4+ K2SO4 + 2H2SO4
Câu 16. Phát biểu nào sau đây không đúng?
A. Lưu huỳnh là một phi kim mạnh, có tính oxi hóa mạnh điển hình
B. Khi tham gia phản ứng, lưu huỳnh thể hiện tính oxi hóa hoặc tính khử
C. Điều kiện thường, lưu huỳnh là chất rắn, màu vàng, không tan trong nước
D. Điều kiện thường, lưu huỳnh tồn tại dạng phân tử tám nguyên tử S8
Lời giải:
Đáp án: A
Câu 17. Trong các câu sau đây, câu nào sai?
A. Khi sục SO2 vào dung dịch NaOH theo tỉ lệ 1< nNaOH/nSO2< 2 thu được hỗn hợp 2 muối Na2SO3và NaHSO3.
B. Sục SO2 vào dung dịch K2CO3 tạo khí CO2.
C. SO2 vừa có tính oxi hóa, vừa có tính khử.
D. SO2 làm mất màu dung dịch brom.
Lời giải:
Đáp án: B
Giải thích:
Câu sai là: Sục SO2vào dung dịch K2CO3 tạo khí CO2. SO2 không đẩy được CO2 ra khỏi dung dịch
Câu 18. Nhỏ HCl vào ống nghiệm chứa Na2S thu được hiện tượng là
A. Có khí không màu, mùi trứng thối thoát ra.
B. Có khí màu nâu đỏ thoát ra.
C. Có khí màu vàng lục, mùi xốc thoát ra.
D. Không có hiện tượng gì.
Lời giải:
Đáp án: A
Giải thích:
Na2S + 2HCl → 2NaCl + H2S↑
H2S: khí không màu, mùi trứng thối.