Al(OH)3 + NaOH → NaAlO2 + H2O | Al(OH)3 ra NaAlO2
Sinx.edu.vn xin giới thiệu phương trình Al(OH)3 + NaOH → NaAlO2 + H2O là phản ứng trao đổi. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng Al(OH)3 + NaOH → NaAlO2 + H2O
1. Phương trình phản ứng Al(OH)3 tác dụng với NaOH
Al(OH)3 + NaOH → NaAlO2 + 2H2O
2. Điều kiện phản ứng Al(OH)3 ra NaAlO2
Nhiệt độ: 1000°C.
3. Cách tiến hành phản ứng Al(OH)3 tác dụng với NaOH
Cho dung dịch Al(OH)3 từ từ và ống nghiệm chứa sẵn dung dịch NaOH.
4. Hiện tượng phản ứng Al(OH)3 tác dụng với NaOH
Sản phẩm thu được chất rắn màu trắng.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của Al(OH)3 (Nhôm hidroxit)
Al(OH)3 là một hidroxit lưỡng tính nên có thể tác dụng được với axit mạnh và dung dịch có tính kiềm mạnh.
5.2. Bản chất của NaOH (Natri hidroxit)
NaOH là một bazơ mạnh nên tác dụng được với hợp chất lưỡng tính như Al(OH)3 hoặc Al2O3.
6. Mở rộng kiến thức về Nhôm hidroxit
6.1. Về tính chất vật lý
Al(OH)3 là một loại hợp chất hóa học dạng rắn, không tan được trong nước (ở bất cứ điều kiện nhiệt độ nào)
6.2. Tính chất hóa học của Al(OH)3
Kém bền với nhiệt: Khi đun nóng Al(OH)3 phân hủy thành Al2O3.
2Al(OH)3 Al2O3 + 3H2O
- Là hiđroxit lưỡng tính
Tác dụng với axit mạnh:
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Tác dụng với dung dịch kiềm mạnh:
Al(OH)3 + KOH → KAlO2 + 2H2O
Al(OH)3 + KOH → K[Al(OH)4]
6.3. Cách điều chế nhôm hydroxit
Kết tủa ion Al3+
Phương trình hóa học: Al3+ + 3OH- (vừa đủ) → Al(OH)3
Phương trình hóa học: Al3+ + 3NH3 + 3H2O → Al(OH)3 + 3NH4+
Phương trình hóa học: 3NaOH + AlCl3 → 3NaCl + Al(OH)3
Kết tủa AlO2-:
Phương trình hóa học: AlO2- + CO2+ 2H2O → Al(OH)3 + HCO3-
Phương trình hóa học: AlO2- + H+ (vừa đủ) + H2O → Al(OH)3
Phương trình hóa học: NaAlO2+ CO2 + 2H2O → Al(OH)3 + NaHCO3
6.4. Ứng dụng
– Dược phẩm:
Thuốc kháng axit dạ dày: Nhôm hidroxit được sử dụng trong các loại thuốc dùng để giảm triệu chứng đầy bụng, trào ngược dạ dày, và đau dạ dày. Nó hoạt động bằng cách làm giảm acid dạ dày.
– Chất xử lý nước:
Nhôm hidroxit được sử dụng để điều chỉnh độ pH trong nước, đặc biệt trong quá trình xử lý nước cung cấp cho các hộ gia đình và các nhà máy xử lý nước.
– Công nghiệp dệt may và giấy:
Nhôm hidroxit được sử dụng làm chất tẩy trắng trong công nghiệp dệt may và giấy để làm cho sợi vải và giấy trắng hơn.
– Công nghiệp hóa chất:
Chất chống cháy: Nhôm hidroxit được sử dụng làm chất chống cháy trong sản xuất vật liệu cần độ bền chống cháy cao, như các vật liệu xây dựng hoặc vật liệu điện tử.
– Sản xuất nhôm:
Nhôm hidroxit là nguyên liệu chính để sản xuất nhôm. Quá trình nhiệt phân nhôm hidroxit tạo ra nhôm oxit, một bước quan trọng trong quá trình sản xuất nhôm.
– Mỹ phẩm và chăm sóc cá nhân:
Do khả năng tạo gel của nó trong nước, nhôm hidroxit thường được sử dụng trong các sản phẩm mỹ phẩm như kem dưỡng da và mỹ phẩm trang điểm.
– Chất phụ gia thực phẩm:
Nhôm hidroxit cũng được sử dụng như một chất phụ gia thực phẩm để điều chỉnh độ pH hoặc làm chất chống đông.
– Công nghiệp sản xuất giấy và sợi tổng hợp:
Nhôm hidroxit có thể được sử dụng để điều chỉnh độ pH trong quá trình sản xuất giấy và sợi tổng hợp.
– Sản xuất thuốc nhuộm và chất tẩy trắng:
Nhôm hidroxit có thể được sử dụng như một chất nền trong các loại thuốc nhuộm và chất tẩy trắng.
– Chất xử lý nước thải:
Nó được sử dụng trong các ứng dụng xử lý nước thải để kết tủa các chất hữu cơ và các kim loại nặng.
Nhôm hidroxit đóng vai trò quan trọng trong nhiều lĩnh vực công nghiệp và tiếp tục được sử dụng rộng rãi trong các ứng dụng khác nhau.
7. Tính chất hoá học của NaOH
NaOH là một bazơ mạnh nó sẽ làm quỳ tím chuyển màu xanh, còn dung dịch phenolphtalein thành màu hồng. Một số phản ứng đặc trưng của Natri Hidroxit được liệt kê ngay dưới đây.
Phản ứng với axit tạo thành muối + nước:
NaOHdd + HCldd→ NaCldd + H2O
Phản ứng với oxit axit: SO2, CO2…
2NaOH + SO2→ Na2SO3 + H2O
NaOH + SO2→ NaHSO3
Phản ứng với axit hữu cơ tạo thành muối và thủy phân este, peptit:
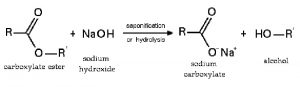
Phản ứng với muối tạo bazo mới + muối mới (điều kiện: sau phản ứng phải tạo thành chất kết tủa hoặc bay hơi):
2NaOH + CuCl2→ 2NaCl + Cu(OH)2↓
Tác dụng với kim loại lưỡng tính:
2NaOH + 2Al + 2H2O→ 2NaAlO2 + 3H2↑
2NaOH + Zn → Na2ZnO2 + H2↑
Tác dụng với hợp chất lưỡng tính:
NaOH + Al(OH)3 → NaAl(OH)4
2NaOH + Al2O3 → 2NaAlO2 + H2O
8. Bài tập vận dụng liên quan
Câu 1. Nhỏ từ từ cho đến dư dung dịch NaOH vào dung dịch AlCl3 hiện tượng xảy ra là
A. Có kết tủa keo trắng, sau đó kết tủa tan.
B. Chỉ có kết tủa keo trắng.
C. Có kết tủa keo trắng và khí bay lên.
D. Không có kết tủa, có khí bay lên.
Lời giải:
Đáp án: A
Nhỏ từ từ cho đến dư dung dịch NaOH vào dung dịch AlCl3, ban đầu có kết tủa keo trắng xuất hiện.
3NaOH + AlCl3→ Al(OH)3 ↓ + 3NaCl
Sau đó kết tủa keo trắng tan trong NaOH dư tạo dung dịch trong suốt (vì Al(OH)3 có tính lưỡng tính tan được trong dung dịch axit dư, và kiềm dư)
NaOH + Al(OH)3 → NaAlO2+ 2H2O
Câu 2. Các đồ vật bằng nhôm bền trong không khí và nước là do:
A. Có một lớp Al(OH)3 bên ngoài bảo vệ
B. Có một lớp Al2O3 bên ngoài bảo vệ
C. Nhôm không tan trong nước
D. Nhôm bền, không bị oxi hóa
Lời giải:
Đáp án: B
Nhôm bền trong môi trường không khí và nước là do có màng oxit Al2O3 bền vững bảo vệ
Khi nhôm tác dụng chậm với oxi và hơi nước, chúng tạo thành một lớp nhôm oxit (Al2O3).
Lớp nhôm oxit này bám rất chắc vào bề mặt nhôm. Và ngăn chặn hoàn toàn không cho oxi tác dụng trực tiếp với nhôm. Do đó, nhôm bền trong môi trường không khí là nhờ lớp bảo vệ nhôm oxit ngay cả khi đun nóng
Câu 3. Chất nào dưới đây có thể tác dụng được với HCl và dung dịch NaOH
A. CuO
B. Fe(OH)3
C. Al(OH)3
D. Al(NO3)3
Lời giải:
Đáp án: C
Phương trình phản ứng xảy ra
Al(OH)3 + NaOH → NaAlO2 + 2H2O
Al(OH)3 + 3HCl → AlCl3+ 3H2O
Câu 4. Dãy các chất đều phản ứng được với kim loại nhôm là:
A. O2, Cl2, NaOH
B. O2, Cl2, Mg(OH)2
C. O2, S, HNO3 đặc, nguội
D. O2, S, MgCl2
Lời giải:
Đáp án: A
Câu 5. Dãy chất nào dưới đây phản ứng được NaOH?
A. Al2O3; Al(OH)3; NaNO3
B. Al2O3; Fe, Al(OH)3
C. Al(NO3)3, HCl, CO2
D. FeCl3, Ag, CO2
Lời giải:
Đáp án: C
Phương trình phản ứng liên quan
Al(NO3)3 + 3NaOH → Al(OH)3 + 3NaNO3
NaOH + HCl → NaCl + H2O
CO2 + NaOH → Na2CO3 + H2O
Câu 6. Thổi V lít khí CO2 (đktc) vào 100ml dd Ca(OH)2 1M thu được 6 gam kết tủa. Lọc kết tủa đun nóng dd lại thấy có kết tủa nữa. Tìm V?
A. 1,08 lít
B. 3,136 lít
C. 2,24 lít
D. 3,36 lít
Lời giải:
Đáp án: B
nkết tủa = 6/100= 0,06 mol
Vì đun nóng lại thu được kết tủa nên dd thu được 2 muối: CaCO3; Ca(HCO3)2.
Phương trình hóa học
CO2+ Ca(OH)2 → CaCO3 + H2O
0,06
2CO2 + Ca(OH)2 → Ca(HCO3)2.
0,08 0,04
→ n(CO2) = 0,06 + 0,08 = 0,14. → V = 3,136 lít.
Câu 7. Phát biểu nào dưới đây là sai ?
A. Cho từng viên Na vào dung dịch AlCl3, xảy ra hiện tượng Natri tan, sủi bọt khí, có xuất hiện kết tủa keo trắng, sau đó kết tủa tan
B. Al(OH)3, Al2O3, Al đều là các chất lưỡng, tính
C. Nhôm là kim loai nhẹ và có khả năng dẫn điện Iot
D. Từ Al2O3 có thế điều chế được Al.
Lời giải:
Đáp án: B
A đúng vì đầu tiên Na tác dụng với nước, tan và tạo bọt khí, sau đó tạo kết tủa Al(OH)3, khi Na dư kết tủa sẽ tan
B Sai vì chỉ có Al(OH)3, Al2O3, là các chất lưỡng, tính còn Al không phải là chất lưỡng tính
C. Đúng
D đúng
Câu 8. Cho sơ đồ phản ứng sau: Al → X → Y → Al(OH)3. Trong sơ đồ trên, mỗi mũi tên là một phản ứng, các chất X, Y lần lượt là
A. NaAlO2 và Al(OH)3
B. Al2O3 và Al(NO3)3
C. Al(OH)3 và Al2O3
D. Al(OH)3 và Al(NO3)3
Lời giải:
Đáp án: B
Phương trình phản ứng hóa học
4Al + 3O2 → 2Al2O3
Al2O3 + 6HNO3 → 2Al(NO3)3 + 3H2O
Al(NO3)3 + 3NH3+ 3H2O → Al(OH)3 + 3NH4NO3
Câu 9. Phát biểu nào dưới đây đúng trong các câu sau:
A. Nhôm là kim loại lưỡng tính.
B. Al(OH)3 là một bazo lưỡng tính có thể tác dụng HCl và NaOH
C. Al(OH)3 là một hidroxit lưỡng tính có thể tác dụng HCl và NaOH
D. Al2O3 là oxit trung tính.
Lời giải:
Đáp án: C
A sai vì Nhôm không phải là kim loại lưỡng tính.
B sai Al(OH)3 là một hidroxit lưỡng tính có thể tác dụng HCl và NaOH
C đúng
D sai Al2O3 là oxit lưỡng tính
Câu 10. Nhôm bị thụ động trong dung dịch nào sau đây
A. H2SO4 đặc nóng
B. HNO3 đặc nguội
C. H2SO4 loãng
D. HNO3 đặc nóng
Lời giải:
Đáp án: B
Nhôm bị thụ động trong dung dịch: HNO3 đặc nguội
Câu 11. Criolit (còn gọi là băng thạch) có công thức phân tử Na3AlF6, được thêm vào Al2O3 trong quá trình điện phân Al2O3 nóng chảy để sản xuất nhôm. Cho các tác dụng sau:
(1) Bảo vệ điện cực khỏi bị ăn mòn.
(2) Làm tăng độ dẫn điện của Al2O3 nóng chảy
(3) Làm giảm nhiệt độ nóng chảy của Al2O3
(4) Tạo lớp ngăn cách để bảo vệ Al nóng chảy
Tác dụng của Criolit là đúng
A. (1), (2), (3), (4)
B. (1), (2), (3)
C. (2), (3), (4)
D. (1), (2), (4)
Lời giải:
Đáp án: C
(2) Làm tăng độ dẫn điện của Al2O3 nóng chảy
(3) Làm giảm nhiệt độ nóng chảy của Al2O3
(4) Tạo lớp ngăn cách để bảo vệ Al nóng chảy
Câu 12. Cho các thí nghiệm sau:
(1). Sục khí CO2 vào dung dịch natri aluminat.
(2). Cho dung dịch NH3 dư vào dung dịch AlCl3 .
(3). Sục khí H2S vào dung dịch AgNO3.
(4). Dung dịch NaOH dư vào dung dịch AlCl3.
(5). Dung dịch NaOH dư vào dung dịch Ba(HCO3)2.
Những trường hợp thu được kết tủa sau phản ứng là:
A. (1), (2), (5)
B. (2), (3), (4), (5)
C. (2), (3), (5)
D. (1), (2), (3), (5)
Lời giải:
Đáp án: A
(1). Sục khí CO2 vào dd natri aluminat.
2H2O + NaAlO2 + CO2 → Al(OH)3 + NaHCO3
(2). Cho dung dịch NH3 dư vào dd AlCl3:
AlCl3 + 3H2O + 3NH3 → Al(OH)3↓ + 3NH4Cl
(3). Sục khí H2S vào dd AgNO3.
2AgNO3 + H2S → 2HNO3 + Ag2S
(4). Dung dịch NaOH dư vào dd AlCl3. Không có kết tủa vì bị tan
AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl
Al(OH)3 + NaOH → NaAlO2 + 2H2O
(5). Dung dịch NaOH dư vào dd Ba(HCO3)2.
2NaOH + Ba(HCO3)2 → 2H2O + Na2CO3 + BaCO3 ↓
Câu 13. Kim loại vừa tác dụng với dung dịch HCl vừa tác dụng với dung dịch KOH là:
A. Fe
B. Mg
C. Na
D. Al
Lời giải:
Đáp án: D
Al vừa tác dụng với dung dịch HCl vừa tác dụng với dung dịch NaOH
Phương trình hóa học
2Al + 6HCl → 2AlCl3 + 3H2↑
Al + NaOH + H2O → NaAlO2 + 3232H2↑
Câu 14. Cho các kim loại: Cu, Zn, Fe, Mg, Ag, Al. Những kim loại nào không tác dụng với dd HNO3 đặc nguội?
A. Fe, Mg, Ag, Al.
B. Cu, Mg, Ag, Al.
C. Fe, Al.
D. Tất cả các kim loại
Lời giải:
Đáp án: C
2 kim loại không phản ứng với dung dịch HNO3 đặc nguội là Fe và Al