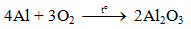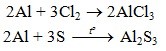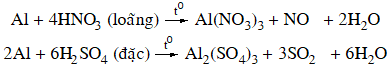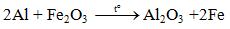Al + Fe2O3 → Al2O3 + Fe | Al ra Al2O3 | Al ra Fe | Fe2O3 ra Al2O3 | Fe2O3 ra Fe
Sinx.edu.vn xin giới thiệu phương trình Al + Fe2O3 → Al2O3 + Fe là phản ứng nhiệt nhôm. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng Al + Fe2O3 → Al2O3 + Fe
1. Phương trình phản ứng
2Al + Fe2O3 Al2O3 + 2Fe
2. Điều kiện phản ứng
Nhiệt độ: 2000oC, có Mg làm mồi
3. Phản ứng nhiệt nhôm
Phản ứng nhiệt nhôm được định nghĩa là phản ứng hóa học tỏa nhiệt trong đó nhôm là chất khử ở trong nhiệt độ cao.
Phương trình tổng quát:
Al + oxit kim loại oxit nhôm + kim loại
(Hỗn hợp X) (Hỗn hợp Y)
4. Phản ứng nhiệt nhôm thường gặp
Ví dụ nổi bật nhất là phản ứng giữa oxit sắt III (Fe2O3) và nhôm (Al):
2Al + Fe2O3 2Fe + Al2O3
Một số phản ứng khác như:
8Al + 3Mn3O4 4Al2O3 + 9Mn
Cr2O3 + 2Al Al2O3 + 2Cr
5. Tính chất hoá học của Al
Nhôm là kim loại có tính khử mạnh: Al → Al3+ + 3e
5.1. Tác dụng với phi kim
a) Tác dụng với oxi
Al bền trong không khí ở nhiệt độ thường do có lớp màng oxit Al2O3 rất mỏng bảo vệ.
b) Tác dụng với phi kim khác
5.2. Tác dụng với axit
+ Axit không có tính oxi hóa: dung dịch axit HCl, H2SO4 loãng
2Al + 6HCl → 2AlCl3 + 3H2↑
+ Axit có tính oxi hóa mạnh: dung dịch HNO3 loãng, HNO3 đặc, nóng và H2SO4 đặc, nóng.
Nhôm bị thụ động hoá trong dung dịch HNO3 đặc, nguội hoặc H2SO4 đặc nguội.
5.3. Tác dụng với oxit kim loại (Phản ứng nhiệt nhôm)
Lưu ý: Nhôm chỉ khử oxit của các kim loại đứng sau nhôm
5.4. Tác dụng với nước
Phá bỏ lớp oxit trên bề mặt Al (hoặc tạo thành hỗn hống Al-Hg thì Al sẽ phản ứng với nước ở nhiệt độ thường)
2Al + 6H2O → 2Al(OH)3↓ + 3H2↑
5.5. Tác dụng với dung dịch kiềm
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
5.6. Tác dụng với dung dịch muối
Al đẩy được kim loại đứng sau ra khỏi dung dịch muối của chúng:
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
5.7. Ứng dụng
Máy cắt rất dễ kiếm và các bộ phận trong nhà máy sản xuất được làm bằng Al. Với đặc tính sáng và không rỉ sét, Al dần trở thành vật liệu không thể thiếu đối với mọi nhà máy. Một số mặt hàng được làm bằng Al, chẳng hạn như: Khung xe máy, khung xe hơi, thùng xe tải, các chi tiết tản nhiệt...
Đặc biệt, Al được sử dụng trong sản xuất trong ngành hàng không vũ trụ. Thân máy bay và cánh được làm bằng nhôm. Các ứng dụng dựa vào trọng lượng riêng nhẹ và bền của nhôm là rất cần thiết để tiết kiệm tối đa trọng lượng trong không khí.
6. Tính chất hóa học của Fe2O3
Fe2O3 là một oxit của sắt, Fe2O3 là dạng phổ biến nhất của sắt oxit tự nhiên. Ngoài ra có thể lấy chất này từ đất sét màu đỏ.
Công thức phân tử: Fe2O3
Là chất rắn, nâu đỏ, không tan trong nước.
6.1. Tính oxit bazơ Fe2O3
Fe2O3 tác dụng với dung dịch axit tạo ra dung dịch bazơ tạo ra dung dịch muối và nước.
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
Fe2O3 + 6HNO3 → 2Fe(NO3)3+ 3H2O
6.2. Tính oxi hóa của Fe2O3
Fe2O3 là chất oxi hóa khi tác dụng với các chất khử mạnh ở nhiệt độ cao như: H2, CO, Al:
Fe2O3 + 3H2 → 2Fe + 3H2O
Fe2O3 + 3CO → 2Fe + 3CO2
Fe2O3+ 2Al → Al2O3 + 2Fe
7. Bài tập phản ứng nhiệt nhôm
Câu 1. Phản ứng hóa học xảy ra trong trường hợp nào dưới đây không thuộc loại phản ứng nhiệt nhôm?
A. Al tác dụng với H2SO4 đặc, nóng.
B. Al tác dụng với CuO nung nóng.
C. Al tác dụng với Fe2O3 nung nóng.
D. Al tác dụng với Fe3O4 nung nóng.
Lời giải:
Đáp án: A
Phản ứng nhiệt nhôm là phản ứng dùng nhôm để khử các oxit kim loại yếu hơn, phản ứng nhiệt nhôm thuộc loại phản ứng oxi hóa khử trong đó nhôm là chất khử.Al tác dụng với H2SO4 đặc, nóng không phải là phản ứng nhiệt nhôm.
Câu 2. Để giữ cho các đồ dùng, đồ vật làm từ kim loại nhôm được bền, đẹp thì cần phải:
(1) Ngâm đồ vật trong nước xà phòng đặc, nóng, để làm sạch.
(2) Không nên cho đồ vật tiếp xúc với dung dịch nước chanh, giấm ăn.
(3) Dùng giấy nhám, chà trên bề mặt của vật, để vật được sạch và sáng.
(4) Bảo vệ bề mặt của vật như nhà thiết kế, sản xuất ban đầu.
Cách nào làm trên là đúng:
A. 1 và 2
B. 1 và 3
C. 1 và 4
D. 2 và 4
Lời giải:
Đáp án: D
Để giữ cho các đồ vật làm từ kim loại nhôm được bền, đẹp thì cần phải :
(2) Không nên cho đồ vật tiếp xúc với dung dịch nước chanh, giấm ăn vì nhôm tác dụng với axit.
(4) Bảo vệ bề mặt của vật như nhà thiết kế, sản xuất ban đầu.
Câu 3. Hỗn hợp X gồm Fe2O3 và Al có tỉ lệ mol tương ứng là 1:3. Thực hiện phản ứng nhiệt nhôm X (không có không khí) đến khi phản ứng xảy ra hoàn toàn thu được hỗn hợp gồm
A. Al2O3 và Fe
B. Al, Fe và Al2O3
C. Al, Fe, Fe3O4 và Al2O3
D. Al2O3, Fe và Fe3O4
Lời giải:
Đáp án: B
Phương trình phản ứng hóa học xảy ra
8Al + Fe3O4 4Al2O3↓ + 9Fe
⇒ nFe3O4/nAl = 3/8 < 1/3 ⇒ Al còn Fe3O4 hết
⇒ Hỗn hợp sản phẩm gồm Al2O3, Fe và Al
Câu 4. Trộn 8,1 (g) bột Al với 48g bột Fe2O3 rồi tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí, kết thúc thí nghiệm lượng chất rắn thu được là:
A. 61,5 g
B. 56,1 g
C. 65,1g
D. 51,6 g
Lời giải:
Đáp án: B
Áp dụng định luật bảo toàn khối lượng ta có :
mc.rắn = mAl + mFe2O3 = 8,1 + 48 = 56,1 g
Câu 5. Phương trình nào sau đây là phản ứng nhiệt nhôm?
A. H2 + CuO Cu + H2O.
B. 3CO + Fe2O3 2Fe + 3CO2.
C. 2Al + Cr2O3 Al2O3 + 2Cr.
D. Al2O3 + 2KOH → 2KAlO2 + H2O.
Lời giải:
Đáp án: C
Câu 6. Cho sơ đồ phản ứng : Al → X → Al2O3→ Al
X có thể là
A. AlCl3.
B. NaAlO2.
C. Al(NO3)3.
D. Al2(SO4)3.
Lời giải:
Đáp án: C
Sơ đồ phản ứng
Al → Al(NO3)3. → Al2O3 → Al
Phương trình phản ứng minh họa
Al + 4HNO3→ Al(NO3)3 + NO + 2H2O
4Al(NO3)3→ 2Al2O3 + 12NO2 + 3O2
2Al2O3 → 4Al + 3O2
Câu 7. Trong các cặp chất sau đây, cặp chất nào có thể cùng tồn tại trong một dung dịch?
A. AlCl3 và Na2CO3
B. HNO3 và NaHCO3
C. NaNO3 và KOH
D. NaCl và AgNO3
Lời giải:
Đáp án: C
Cặp chất có thể cùng tồn tại trong một dung dịch là chúng không phản ứng với nhau
Loại A vì AlCl3 phản ứng với Na2CO3
3Na2CO3 + 2AlCl3 + 3H2O → 2Al(OH)3+ 3CO2+ 6NaCl
Loại B vì HNO3 phản ứng với NaHCO3
NaHCO3 + HNO3→ NaNO3 + CO2↑ + H2O
Loại D vì NaCl phản ứng với AgNO3
NaCl + AgNO3 → AgCl + NaNO3
Câu 8. Đốt nóng một hỗn hợp gồm Al và 8 gam Fe2O3 (trong điều kiện không có không khí) đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn R. Cho X tác dụng vừa đủ với V ml dung dịch NaOH 1M sinh ra 1,68 lít H2 (ở đktc). Giá trị của V là
A. 150.
B. 100.
C. 200.
D. 300.
Lời giải:
Đáp án: A
Ta có phương trình phản ứng
2Al + Fe2O3 → Al2O3 + 2Fe (1)
Vì X tác dụng với NaOH tạo 0,075 mol H2 => Al dư
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Vì nH2 = 0,075 => nAl dư = nH2 = 0,05 mol
nFe2O3 = 0,05 => nAl (1) = 0,1 mol
=> Tổng số mol Al dùng là:
Theo bảo toàn nguyên tố (để ý tỉ lệ Na:Al trong NaAlO2 là 1:1)
=> nNa+ = 0,15 mol => V = 150 ml
Câu 9. Phản ứng hóa học xảy ra trong trường hợp nào dưới đây không thuộc loại phản ứng nhiệt nhôm?
A. Al tác dụng với H2SO4 đặc, nóng.
B. Al tác dụng với CuO nung nóng.
C. Al tác dụng với Fe2O3 nung nóng.
D. Al tác dụng với Fe3O4 nung nóng.
Lời giải:
Đáp án: A
Phản ứng nhiệt nhôm là phản ứng dùng nhôm để khử các oxit kim loại yếu hơn, phản ứng nhiệt nhôm thuộc loại phản ứng oxi hóa khử trong đó nhôm là chất khử.
=> A không phải là phản ứng nhiệt nhôm.
Câu 10. Phản ứng nào sau đây là phản ứng nhiệt nhôm?
A. 4Al + 3O2 2Al2O3
B. 2Al + 2NaOH + 2H2O 2NaAlO2 + 3H2
C. Al + 4HNO3 Al(NO3)3 + NO + 2H2O
D. 2Al + Fe2O3 2Fe + Al2O3
Lời giải:
Đáp án: D
Phản ứng nhiệt nhôm: Kim loại nhôm tác dụng được với một số oxit kim loại ở nhiệt độ cao tạo thành kim loại và nhôm oxit.
Vậy phản ứng nhiệt nhôm là: 2Al + Fe2O3 → 2Fe + Al2O3.
Câu 11. Tính chất nào sau đây không phải của nhôm?
A. Là kim loại màu trắng bạc, mềm, dễ kéo sợi và dát mỏng.
B. Nhôm dẫn điện và dẫn nhiệt tốt, tốt hơn các kim loại Fe và Cu.
C. Nhôm là nguyên tố p.
D. Nhôm là kim loại nhẹ.
Lời giải:
Đáp án: B
Câu 12. Nhôm thể hiện tính chất nào sau đây?
1) Là kim loại màu trắng bạc, mềm, dễ kéo sợi và dát mỏng.
2) Nhôm dẫn điện và dẫn nhiệt tốt, tốt hơn các kim loại Fe và Cu.
3) Nhôm là kim loại nhẹ.
4) Nhôm là nguyên tố s.
A. 1, 2
B. 2, 4
C. 3
D. 1, 3
Lời giải:
Đáp án: D
Các tính chất vật lí của nhôm là
1) Là kim loại màu trắng bạc, mềm, dễ kéo sợi và dát mỏng.
3) Nhôm là kim loại nhẹ, nóng chảy ở nhiệt độ 660oC.
4) sai Nhôm là nguyên tố p.
(2) sai vì nhôm dẫn điện kém hơn đồng.
Câu 13. Cho các ống nghiệm đựng các dung dịch sau: HCl, H2SO4 đặc nguội, ZnCl2, KCl. Thả bột nhôm vào các ống nghiệm thấy có hiện tượng lần lượt là
A. sủi bọt khí, không hiện tượng, xuất hiện kết tủa màu đỏ, không hiện tượng.
B. không hiện tượng, sủi bọt khí, không hiện tượng, xuất hiện kết tủa vàng.
C. xuất hiện khói trắng, sủi bọt khí, xuất hiện kết tủa nâu đỏ, không hiện tượng.
D. sủi bọt khí, xuất hiện khói trắng, xuất hiện kết tủa màu đỏ, không hiện tượng.
Lời giải:
Đáp án: A
Thả bột nhôm vào
Dung dịch HCl: có khí không màu: 2Al + 6HCl → 2AlCl3 + 3H2.
Dung dịch H2SO4 đặc nguội không có hiện tượng.
Dung dịch ZnCl2 có kết tủa màu đỏ (Cu): 2Al + 3ZnCl2 → 2AlCl3 + 3Zn.
Dung dịch KCl không có hiện tượng.
Câu 14. Nhúng thanh nhôm vào dung dịch Cu(NO3)2 sau một thời gian thấy hiện tượng gì xảy ra:
A. màu xanh lam nhạt dần và có kết tủa màu đỏ lắng xuống đáy ống nghiệm.
B. màu xanh lam chuyển dần nâu đỏ và có chất rắn màu đỏ bám vào thanh nhôm.
C. màu xanh lam đậm dần và có chất rắn màu trắng bám vào thanh nhôm.
D. màu xanh lam nhạt dần và có chất rắn màu đỏ bám vào thanh nhôm.
Lời giải:
Đáp án: D
Nhúng thanh nhôm vào dung dịch Cu(NO3)2 sau một thời gian thấy hiện tượng màu xanh lam nhạt dần và có chất rắn màu đỏ bám vào thanh nhôm.
2Al + 3CuSO4 (dd màu xanh) → 3Cu + Al2(SO4)3
Dây nhôm nhuốm màu đỏ.
Màu xanh của dung dịch phai dần.