Fe + H2SO4 (đặc, nóng) → Fe2(SO4)3 + SO2 + H2O l Fe ra Fe2(SO4)3 | H2SO4 ra Fe2(SO4)3 | H2SO4 ra SO2
Sinx.edu.vn xin giới thiệu phương trình Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O là phản ứng oxi hóa khử. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng Fe + H2SO4(đặc, nóng) → Fe2(SO4)3 + SO2 + H2O
1. Phương trình phản ứng Fe tác dụng H2SO4 đặc nóng
2Fe + 6H2SO4(đặc, nóng) → Fe2(SO4)3 + 3SO2↑ + 6H2O
2. Cân bằng phản ứng oxi hoá khử (theo phương pháp thăng bằng electron)
0Fe+H2+6SO4(đặc nóng)→+2Fe2(SO4)3++4SO4+H2OFe0+H2S+6O4(đặc nóng)→Fe+22(SO4)3+S+4O4+H2O
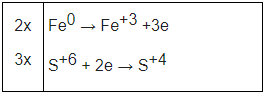
2Fe + 6H2SO4(đặc, nóng) → Fe2(SO4)3 + 3SO2 + 6H2O
3. Điều kiện phản ứng Fe tác dụng với H2SO4 đặc nóng
Nhiệt độ
4. Cách tiến hành phản ứng Fe tác dụng với H2SO4 đặc nóng
Cho Fe (sắt) tác dụng với axit sunfuric H2SO4
5. Hiện tượng Hóa học
Sắt (Fe) tan dần trong dung dịch và sinh ra khí mùi hắc Lưu huỳnh đioxit (SO2).
6. Bản chất của các chất tham gia phản ứng
6.1. Bản chất của Fe (Sắt)
- Trong phản ứng trên Fe là chất khử.
- Fe là kim loại tác dụng được với các axit HNO3, H2SO4 đặc.
6.2. Bản chất của H2SO4 (Axit sunfuric)
- Trong phản ứng trên H2SO4 là chất oxi hoá.
- Trong H2SO4 thì S có mức oxi hoá +6 cao nhất nên H2SO4 đặc có tính axit mạnh, oxi hoá mạnh và háo nước.
7. Tính chất hóa học của Fe
7.1. Tác dụng với phi kim
Với oxi: 3Fe + 2O2 Fe3O4
Với clo: 2Fe + 3Cl2 2FeCl3
Với lưu huỳnh: Fe + S FeS
Ở nhiệt độ cao, sắt phản ứng được với nhiều phi kim.
7.2. Tác dụng với dung dịch axit
Tác dụng với với HCl, H2SO4 loãng
Fe + 2HCl → FeCl2 + H2
Tác dụng với H2SO4 đặc, nóng; HNO3 đặc:
2Fe + 6H2SO4(đặc, nóng) → Fe2(SO4)3 + 3SO2 + 6H2O
Không tác dụng với H2SO4 đặc nguội, HNO3 đặc, nguội
7.3. Tác dụng với dung dịch muối
Đẩy được kim loại yếu hơn ra khỏi muối
Fe + CuSO4 → FeSO4 + Cu
7.4. Ứng dụng của Fe
- Sắt có trong những đồ dùng cá nhân như: dao, kềm, kéo, kệ sắt, các loại dụng cụ gia đình khác,…
- Sắt ở trong các đồ nội thất như: bàn ghế, khung cửa, tủ kệ, cầu thang,…
- Các loại máy móc trong gia đình như máy xay, máy giặt, bồn rửa cũng có sắt.
- Trong giao thông vận tải sắt cũng đóng vai trò rất quan trọng.
- Sắt là bộ khung sườn cho những công trình xây dựng như nhà cửa, cầu, tòa nhà,…
8. Tính chất hóa học của H2SO4
8.1. H2SO4 loãng
Axit sunfuric là một axit mạnh, hóa chất này có đầy đủ các tính chất hóa học chung của axit như:
- Axit sunfuric H2SO4 làm chuyển màu quỳ tím thành đỏ.
- Tác dụng với kim loại đứng trước H (trừ Pb) tạo thành muối sunfat.
Fe + H2SO4 → FeSO4 + H2
- Tác dụng với oxit bazo tạo thành muối mới (trong đó kim loại giữ nguyên hóa trị) và nước .
FeO + H2SO4 → FeSO4 + H2O
- Axit sunfuric tác dụng với bazo tạo thành muối mới và nước.
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
- H2SO4 tác dụng với muối tạo thành muối mới (trong đó kim loại vẫn giữ nguyên hóa trị) và axit mới.
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
8.2. H2SO4 đặc
Axit sunfuric đặc có tính axit mạnh, oxi hóa mạnh với tính chất hóa học nổi bật như:
- Tác dụng với kim loại: Khi cho mảnh Cu vào trong H2SO4 tạo ra dung dịch có màu xanh và có khí bay ra với mùi sốc.
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
- Tác dụng với phi kim tạo thành oxit phi kim + H2O + SO2.
C + 2H2SO4 → CO2 + 2H2O + 2SO2 (nhiệt độ)
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
- Tác dụng với các chất khử khác.
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
- H2SO4 còn có tính háo nước đặc trưng như đưa H2SO4 vào cốc đựng đường, sau phản ứng đường sẽ bị chuyển sang màu đen và phun trào với phương trình hóa học như sau.
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
9. Bài tập vận dụng liên quan
Câu 1. Cho các quặng sau: pirit, thạch cao, mica, apatit, criolit, boxit, dolomit. Số quặng chứa nhôm là:
A.2.
B. 3.
C. 4.
D. 5.
Lời giải:
Đáp án: B
Câu 2. Cho các phản ứng chuyển hóa sau:
NaOH + dung dịch X → Fe(OH)2;
Fe(OH)2+ dung dịch Y → Fe2(SO4)3;
Fe2(SO4)3 + dung dịch Z → BaSO4.
Các dung dịch X, Y, Z lần lượt là
A. FeCl3, H2SO4 đặc nóng, Ba(NO3)2.
B. FeCl3, H2SO4 đặc nóng, BaCl2.
C. FeCl2, H2SO4 đặc nóng, BaCl2.
D. FeCl2, H2SO4 loãng, Ba(NO3)2.
Lời giải:
Đáp án: C
2NaOH + FeCl2 → Fe(OH)2 + 2NaCl
dd X
2Fe(OH)2 + 4H2SO4 đặc → Fe2(SO4)3+ SO2 + 6H2O
dd Y
Fe2(SO4)3 + 3BaCl2 → 3BaSO4 + 2FeCl3
dd Z
Câu 3. Những nhận định sau về kim loại sắt:
(1) Sắt còn có trong hồng cầu của máu, giúp vận chuyển oxi tới các tế bào.
(2) Ion Fe2+ bền hơn Fe3+.
(3) Fe bị thụ động trong H2SO4 đặc nguội.
(4) Quặng manhetit là quặng có hàm lượng sắt cao nhất.
(5) Trong tự nhiên sắt tồn tại ở dạng hợp chất, trong các quặng sắt
(6) Kim loại sắt có thể khử được ion Fe3+.
Số nhận định đúng là
A. 3
B. 4
C. 5
D. 6
Lời giải:
Đáp án: C
(1) đúng
(2) sai, Fe2+ trong không khí dễ bị oxi hóa thành Fe3+
(3) đúng
(4) đúng, quặng manhetit (Fe3O4) là quặng có hàm lượng Fe cao nhất.
(5) đúng
(6) đúng, Fe + 2Fe3+ → 3Fe2+
Vậy có 5 phát biểu đúng
Câu 4. Chất nào dưới đây phản ứng với Fe tạo thành hợp chất Fe (II)?
A. Cl2
B. dung dịch HNO3 loãng
C. dung dịch AgNO3 dư
D. dung dịch HCl đặc
Lời giải:
Đáp án: D
A. Fe + Cl2 → FeCl3
B. Fe + 4HNO3 loãng → Fe(NO3)3 + NO + 2H2O
C. Fe + AgNO3 dư → Fe(NO3)3 + Ag
D: Fe + HCl → FeCl2 + H2
Câu 5. Dãy các chất và dung dịch nào sau đây khi lấy dư có thể oxi hoá Fe thành Fe(III)?
A. HCl, HNO3 đặc, nóng, H2SO4 đặc, nóng
B. Cl2, HNO3 nóng, H2SO4 đặc, nguội
C. bột lưu huỳnh, H2SO4 đặc, nóng, HCl
D. Cl2, AgNO3, HNO3 loãng
Lời giải:
Đáp án: D
A. 2HCl + Fe → FeCl2 + H2
B. Fe thụ động H2SO4 đặc, nguội
C. 2HCl + Fe → FeCl2 + H2
Fe + S → FeS
Câu 6. Cho 5,6 gam Fe tan hoàn toàn trong dung dịch H2SO4 đặc nóng, sau phản ứng thu được V lít SO2 (đktc, sản phẩm khử duy nhất). Giá trị của V là:
A. 6,72 lít
B. 3,36 lít
C. 4,48 lít
D. 2,24 lít
Lời giải:
Đáp án: B
nFe= 5,6565,656=0,1 mol
Quá trình nhường e
Fe0 → Fe+3 + 3e
0,1 → 0,3
Quá trình nhận e
S+6 + 2e → S+4
0,3 0,15
=> VSO2 = 0,15.22,4 = 3,36 lít
Câu 7. Để pha loãng dung dịch H2SO4 đặc trong phòng thí nghiệm, người ta tiến hành theo cách nào dưới đây?
A. Cho từ từ nước vào axit và khuấy đều
B. Cho từ từ axit vào nước và khuấy đều
C. Cho nhanh nước vào axit và khuấy đều
D. Cho nhanh axit vào nước và khuấy đều
Lời giải:
Đáp án: B
H2SO4 tan vô hạn trong nước và tỏa rất nhiều nhiệt. Nếu ta rót nước vào axit, nước sôi đột ngột và kéo theo những giọt axit bắn ra xung quanh gây nguy hiểm trực tiếp đến người thực hiện làm thí nghiệm.
Vì vậy muốn pha loãng axit H2SO4 đặc, người ta phải rót từ từ axit vào nước và khuấy nhẹ bằng đũa thủy tinh mà không được làm ngược lại.
Câu 8. Cho từng chất: Fe, FeO, Fe(OH)2, Fe(OH)3, Fe3O4, Fe2O3, Fe(NO3)2, Fe(NO3)3, FeSO4, Fe2(SO4)3, FeCO3 lần lượt phản ứng với HNO3 đặc, nóng. Số phản ứng thuộc loại phản ứng oxi hóa – khử là
A. 5
B. 6
C. 7
D. 8
Lời giải:
Đáp án: C
phản ứng oxi hóa khử xảy ra khi Fe trong hợp chất chưa đạt số oxi hóa tối đa
=> các chất thỏa mãn là: Fe, FeO, Fe(OH)2, Fe3O4, Fe(NO3)2, FeSO4, FeCO3
Fe + 4HNO3 → Fe(NO3)3 + NO↑ + 2H2O
3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
3Fe(OH)2 + 10HNO3 → 3Fe(NO3)3 + NO + 8H2O
3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO↑ + 14H2O ,
Fe(NO3)2 + 2HNO3→ Fe(NO3)3 + NO2 + H2O,
FeSO4 + 4HNO3→ Fe(NO3)3 + H2SO4 + NO2 + H2O
3FeCO3+ 10HNO3 → 3Fe(NO3)3 + 3CO2 + NO + 5H2O
Câu 9. Cho các phản ứng sau:
1) dung dịch FeCl2 + dung dịch AgNO3
2) dung dịch FeSO4 dư + Zn
3) dung dịch FeSO4 + dung dịch KMnO4+ H2SO4
4) dung dịch FeSO4 + khí Cl2
Số phản ứng mà ion Fe2+ bị oxi hóa là
A. 2
B. 1
C. 4
D. 3
Lời giải:
Đáp án: D
Ion Fe2+ bị oxi hóa tạo thành Fe3+ => có các phản ứng (1), (3), (4)
1) FeCl2 + 3AgNO3→ Fe(NO3)3 + 2AgCl + Ag
2) FeSO4 + Zn → Fe + ZnSO4 => Ion Fe2+ bị khử tạo thành Fe0
3) 10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
4) 6FeSO4 + 3Cl2→ 2Fe2(SO4)3+ 2FeCl3
Câu 10. Nhận xét nào sau đây không đúng?
A. Crom là kim loại cứng nhất trong tất cả các kim loại
B. Nhôm và Crom đều phản ứng với HCl theo cùng tỉ lệ số mol.
C. Vật dụng làm bằng nhôm và crom đều bền trong không khí và nước vì có màng oxit bảo vệ.
D. Sắt và crom đều bị thụ động hóa bởi HNO3 đặc, nguội.
Lời giải:
Đáp án: B
Phương trình phản ứng hóa học
Al + 3HCl → AlCl3 + 3232H2
Cr + 2HCl → CrCl2 + H2
Câu 11. Dung dịch X gồm FeCl2 và FeCl3 được chia làm hai phần bằng nhau:
Phần 1: Tác dụng với dung dịch NaOH dư ở ngoài không khí thu được 0,5 mol Fe(OH)3.
Phần 2: Tác dụng với dung dịch AgNO3 thu được 1,3 mol AgCl. Tỉ lệ mol của FeCl2 và FeCl3 là
A. 4:1.
B. 3:2.
C. 1:4.
D. 2:3.
Lời giải:
Đáp án: D
Đặt số mol FeCl2 và số mol FeCl3 trong mỗi phần lần lượt là a và b mol
Phần 1: Bảo toàn Fe có
nFe(OH)3 = nFeCl2 + nFeCl3 → a + b = 0,5
Phần 2: Bảo toàn Clo có
nAgCl = 2.nFeCl2 + 3.nFeCl3 → 2a + 3b = 1,3
Giải hệ phương trình được a = 0,2 và b = 0,3
→ a : b = 2 : 3.
Câu 12. Cho m gam Mg vào dung dịch chứa 0,18 mol FeCl3. Sau khi phản ứng xảy ra hoàn toàn thu được 6,72 gam chất rắn. Giá trị của m là
A. 2,88 gam.
B. 4,32 gam.
C. 2,16 gam.
D. 5,04 gam.
Lời giải:
Đáp án: D
Nếu Mg dư hoặc vừa đủ:
mchất rắn = mFe + mMg (dư) ≥ nFe = 0,18.56 = 10,08 gam
mà chỉ thua được 6,72 gam chất rắn nên Mg phản ứng hết → nFe = 0,12 mol.
Mg (0,09) + 2Fe3+ (0,18 mol) → Mg2+ + 2Fe2+
Mg (0,12) + Fe2+ → Mg2+ (0,12 mol) + Fe
→ nMg = 0,09 + 0,12 = 0,21 mol → mMg = 0,21.24 = 5,04 gam.
Câu 13. Nung nóng 29 gam oxit sắt với khí CO dư, sau phản ứng, khối lượng chất rắn còn lại là 21 gam. Công thức oxit sắt là
A. FeO.
B. Fe3O4.
C. Fe2O3.
D. FeO hoặc Fe3O4.
Lời giải:
Đáp án: B
Gọi số mol CO tham gia phản ứng là a → số mol CO2 tạo thành là a mol
Vì lượng CO dư → chất rắn chỉ chứa Fe → nFe = 0,375 mol.
FexOy + yCO → xFe + yCO2
Bảo toàn khối lượng → moxit + mCO = mFe + mCO2 → 29 + 28a = 44a + 21
→ a = 0,5 mol → nO = 0,5 mol
→ nFe : nO = 0,3750,50,3750,5 = 3434→ Công thức của oxit sắt là Fe3O4.
Câu 14. Cho 5,4 gam hỗn hợp 2 kim loại Fe và Zn tác dụng hoàn toàn với 90 ml dung dịch HCl 2M. Khối lượng muối thu được là
A. 11,79 gam
B. 11,5 gam
C. 15,71 gam
D. 17,19 gam
Lời giải:
Đáp án: D
nHCl = 0,09. 2 = 0,18 (mol)
Zn + 2HCl → ZnCl2 + H2
Fe + 2HCl → FeCl2 + H2
Từ (1) và (2) nH2 = 1212nHCl= 0,09 (mol)
Theo định luật bảo toàn khối lượng:
mhỗn hợp + m axit = m muối + m hidro
=> m muối = 5,4 + 0,18.36,5 - 0,09.2 = 11,79 gam
Câu 15. Hòa tan hoàn toàn 5 gam hỗn hợp Mg và Fe trong dung dịch HCl 4M thu được 2,8 lít H2 (đktc) và dung dịch Z. Để kết tủa hoàn toàn các ion trong D cần 150 ml dung dịch NaOH 2M. Thể tích dung dịch HCl đã dùng là :
A. 0,1 lít.
B. 0,12 lít.
C. 0,15 lít.
D. 0.075 lít.
Lời giải:
Đáp án: D
Áp dụng định luật bảo toàn nguyên tố Natri
nNaCl = nNaOH = 0,3 (mol)
Áp dụng định luật bảo toàn nguyên tố Clo
=> nHCl = nNaCl = 0,3 (mol)
VHCl = 0,340,34 = 0,075 lít
Câu 16. Cho m gam bột Fe vào dung dịch HNO3 lấy dư, ta được hỗn hợp gồm hai khí NO2 và NO có VX = 8,96 lít (đktc) và tỉ khối đối với O2 bằng 1,3125. Thành phần phần trăm theo thể tích của NO, NO2 và khối lượng m của Fe đã dùng là
A. 25% và 75%; 1,12 gam.
B. 25% và 75%; 5,6 gam.
C. 35% và 65%; 5,6 gam.
D. 45% và 55%; 1,12 gam.
Lời giải:
Đáp án: B
Gọi x, y lần lượt là số mol của NO2, NO.
nHỗn hợp khí = 4,4822,44,4822,4= 0,2 (mol)
=> x + y = 0,2 (1)
Khối lượng mol trung bình của hỗn hợp khí là:
1,3125.32 = 42 (gam/mol)
=> Khối lượng của hỗn hợp khí trên là: 42.0,2 = 8,4 (gam)
=> 46x + 30y = 8,4 (2)
Từ (1) và (2) => x = 0,15; y = 0,05
=> %VNO2 = 0,3/(0,15 + 0,05) . 100% = 75%
%VNO = 25%
Áp dụng đinh luật bảo toàn electron ta có:
3.nFe= 1.nNO2 + 3.nNO
=> 3. nFe = 0,15 + 3 .0,05 = 0,3
=> nFe = 0,330,33 = 0,1 mol
=> mFe= 0,1 .56 = 5,6 gam
Câu 17. Đốt nóng một ít bột Fe trong bình đựng O2 sau đó cho sản phẩm thu được vào dung dịch HCl dư thu được dung dịch X. Dung dịch X có:
A. FeCl2 , HCl dư
B. FeCl3, HCl dư
C. FeCl2 , FeCl3, và HCl dư
D. FeCl3
Lời giải:
Đáp án: C
Đốt Fe trong oxi: Fe + O2 → Fe2O3, Fe3O4, FeO, Fe dư (hỗn hợp X)
Hỗn hợp X + HCl dư FeCl2, FeCl3 và HCl dư
Câu 18. Cho 17,4 gam hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng dư thu được 1,12 lít khí NO (sản phẩm khử duy nhất ở đktc) và dung dịch X. Cô cạn dung dịch X sau phản ứng được m gam muối khan. Giá trị m là:
A. 54,45 gam.
B. 108,9 gam.
C. 49,09 gam.
D. 40,72 gam.
Lời giải:
Đáp án: A
Qui đổi 17,4 gam hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4 là hỗn hợp của x mol Fe và y mol O.
Ta có: mhỗn hợp= 56x + 16y = 17,4 (1)
Bảo toàn e :3nFe = 2nO+ 3nNO => 3x = 2y + 0,15 (2)
Giải hệ (1) và (2) => x = 0,225 mol; y = 0,3 mol
nFe(NO3)3 = nFe = x = 0,225 mol,
=>mFe(NO3)3= 0,225.242 = 54,45 gam
Câu 19. Khi hoà tan cùng một lượng kim loại M vào dung dịch HNO3 loãng và vào dung dịch H2SO4 loãng thì thu được khí NO và H2 có thể tích bằng nhau (đo ở cùng điều kiện). Biết rằng muối nitrat thu được có khối lượng bằng 159,21% khối lượng muối sunfat. Vậy M là kim loại nào sau đây?
A. Zn.
B. Al.
C. Fe.
D. Mg.
Lời giải:
Đáp án: C
M + 2nHNO3 → M(NO3)n + nNO2 + nH2O
a → a → na
2M + xH2SO4 → M2(SO4)x + xH2
a → a2a2 → xa2a2
Thể tích khí đo ở cùng điều kiện nên tỉ lệ thể tích bằng tỉ lệ số mol:
na = 3xa2a2 => n = 3x/2
(2R + 96x).a2a2 = 0,6281.(R + 62n).a
(2R + 96x).a2a2 = 0,6281.(R + 62.(3x23x2)).a
=> R = 28x
Thỏa mãn với n = và R = 56 (Fe).
Câu 20. Cho 11,36 gam hồn hợp gồm Fe, FeO, Fe2O3, Fe3O4 phản ứng hết với dung dịch HNO3 loãng (dư), thu được 1,344 lít khí NO (sản phẩm khử duy nhất, ở đktc) và dung dịch X. Dung dịch X có thể hoà tan tối đa 12,88 gam Fe. Số mol HNO3 có trong dung dịch ban đầu là
A. 0,88.
B. 0,64.
C. 0,94.
D. 1,04.
Lời giải:
Đáp án: C
Coi như hỗn hợp gồm Fe, FeO, Fe2O3, Fe3O4 gồm có x mol Fe và y mol O
Theo đề bài ta có: 56x + 16y= 11,36 (1)
Ta có nNO= 0,06 mol
Qúa trình cho electron:
Fe → Fe3++ 3e
x x mol
Qúa trình nhận electron:
O + 2e→ O-2
y 2y mol
N+5+ 3e → NO
0,18 ← 0,06
Theo định luật bảo toàn electron thì: ne cho= ne nhận nên 3x = 2y+ 0,18 (2)
Từ (1) và (2) ta có x= 0,16 và y= 0,15
Bảo toàn nguyên tố Fe có nFe(NO3)3 = nFe= x= 0,16 mol
nFe hình thành= 0,23 mol
Fe + 4HNO3 → 2H2O + NO + Fe(NO3)3
x 4x x
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
0,23-x x+ 0,16
=> x= 0,1 → nHNO3 = 4.0,1 + 3.0,16 + 0,06 = 0,94 mol